■はじめに
アルツハイマー病(以下、「AD」とします )は認知機能障害をきたす疾患であり、進行とともに記憶や思考能力が徐々に障害されていきます。ADの最大な危険因子は高齢であり、そのほか遺伝や栄養、身体活動、環境因子などが続きます。世界人口の高齢化に伴い認知症は増加の一方であり、2050年までに1億5200万人に増加すると推測されています。認知症のリスク因子とされる中年期の肥満や糖尿病患者を含めば、その数は更に膨れ上がります。しかし、現状では加齢に伴う認知機能障害や認知症を治療する有効な医薬品は存在していません。医薬品は認知症と診断されてから投薬が可能となるため、認知症が発症してからその効果を期待するのは厳しい可能性が考えられます。そのため早い段階からの予防が重要です。
Twendee X®︎(以下、「TwX」とします)は、臨床試験(多施設共同無作為化二重盲検プラセボ対照前向き介入試験)結果から、ヒトにおける軽度認知障害(MCI)に予防効果が認められている抗酸化配合剤です。これまでの数々の基礎実験からTwXは、脳梗塞マウスの梗塞体積を縮小させ、ADモデルマウスにおいては、アミロイドβ(Aβ)および神経細胞損失の減少、神経炎症と酸化ストレスを緩和することで運動協調性や認知機能改善など認知障害の大幅に改善することが多くの共同研究によって証明されてきました。
今回の論文では、TwXがなぜこのような効果を得ることができるのか、ADの危険因子である老齢及び糖尿病マウスを自然に発症させ、認知症の様々な原因を多方面から実験したデータを発表しています。
■論文内容
実験背景
ADは短期記憶障害や認知障害を特徴とした進行性の神経変性疾患であり、すでに変性してしまった神経を元に戻すことができない不可逆的な進行性の脳疾患です。世間一般においてADの原因はAβの蓄積とよく報道さていますが、原因はAβだけではありません。多数の要因が複雑に絡み合った病態であり、これら全てがADの発症と進行に関与しています。そのため、多くの要因を改善出来なければADは進行することになります。
アルツハイマー病(AD)の原因

医薬品は認知症と診断されてから初めて投薬が可能となります。しかし、認知症は臨床症状が出現する20年前から始まるといわれ、認知症が発症してから治療を始めても効果が出ない可能性があります。そのため、早い段階からの予防が大変重要となります。医薬品と位置付けられない抗酸化サプリメントで早い段階から認知症の予防ができれば、発症や進行を遅らせることは可能だと考えられています。
TwXはすでに複数の基礎実験において、脳内のAβやp-tauの減少、神経炎症や酸化ストレスの低減、これらに伴う認知機能改善が報告されています。今回の論文ではTwXの抗酸化力とミトコンドリアへの作用、オートファジー機能不全やテロメア短縮に与える影響を調べることによって、AD予防効果の理由を探りました。
■結果
1. 抗酸化能力
酸化ストレスの元凶である活性酸素(ROS)はあらゆる細胞に作用することで、すばやい反応を繰り返します。そして細胞や遺伝子の損傷、炎症などをもたらします。脳や神経細胞は酸化ストレスに非常に弱いため、過剰な酸化ストレスを抑制することが重要です。
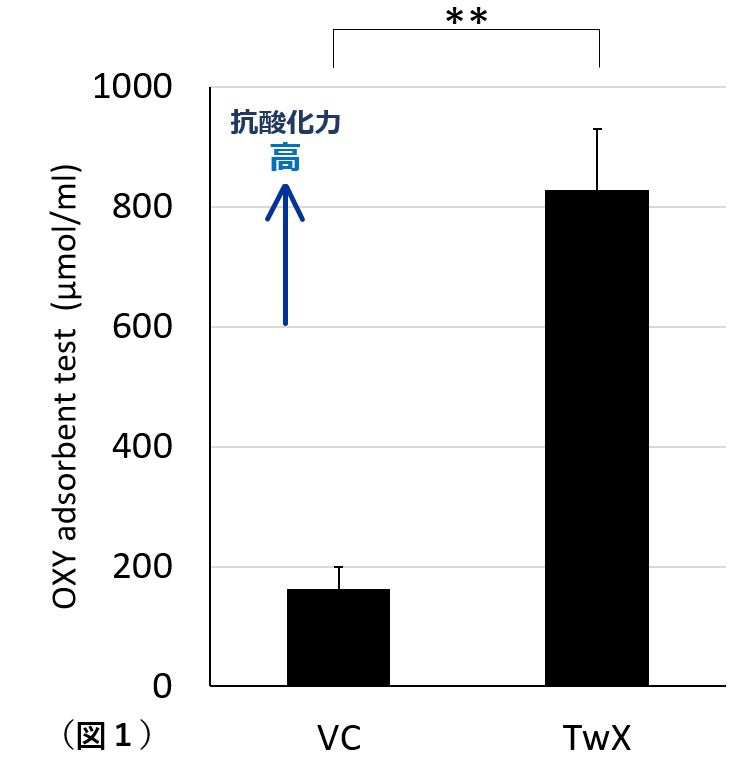
TwXは8種類の有用成分をバランスよく配合されていることによりVitamin C溶液(VC)のような単一成分の抗酸化物よりも抗酸化力が5倍以上も強いことがわかりました(図1) 。細胞内においても、酸化剤による細胞やミトコンドリア内のROSの上昇を有意に抑え、抗酸化酵素を有意に上昇させることが明らかになっています。
2. ミトコンドリアのエネルギー産生
ミトコンドリアは、エネルギー(ATP) の大部分を担う細胞内小器官です。神経細胞のエネルギー伝達経路のほとんどはミトコンドリアで行われますが、加齢によってミトコンドリアの機能が低下します。これは脳の老化の特徴であり、ADなどの神経変性疾患では特に顕著です。ミトコンドリアの機能不全は酸化ストレスを増加させます。エネルギー生産の低下と慢性的な高い酸化ストレスは、脳の老化やアルツハイマー病に伴う認知機能の低下の原因です。
TwXを投与した細胞は、無添加細胞と比較して青枠部分のエネルギー産生(ATP及びADP)が大きく上昇していました(図2)。TwXは、ROSからミトコンドリアを保護することで、エネルギー産生を活発にさせミトコンドリアの機能不全を回避する可能性が示めされました。
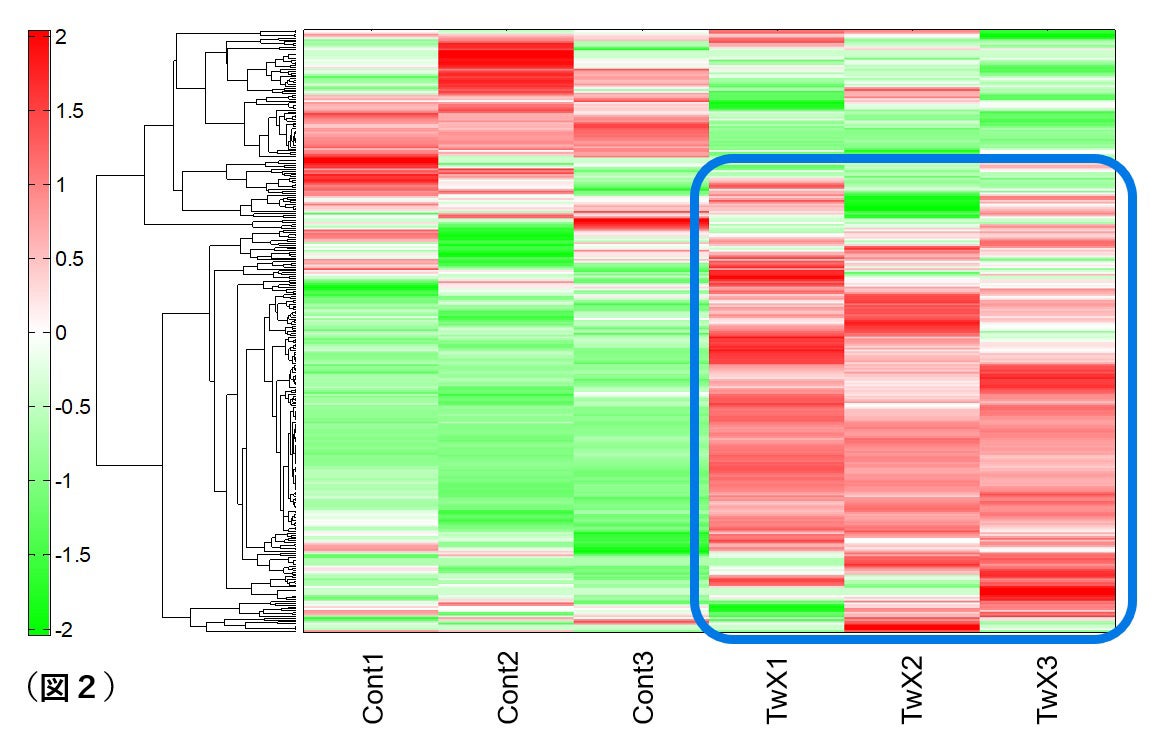
Cont:サプリメント処置無し群、TwX: TwX処置群
3. 糖尿病
糖尿病はADや血管性認知症、その他のあらゆる種類の認知症のリスクを高めることが明らかになっています。糖尿病ではROSの増加やミトコンドリア機能障害、炎症などADと共通した神経変性メカニズムが確認されています。そのため、ADを予防するためには高血糖状態を改善させる必要があります。TwXは高血糖状態の持続によるROSの上昇を抑え、高血糖を改善することが明らかになりました(図5)。この結果、TwXは高血糖状態による血管内皮のダメージを抑制し、認知機能低下を予防する可能性が示唆されました。
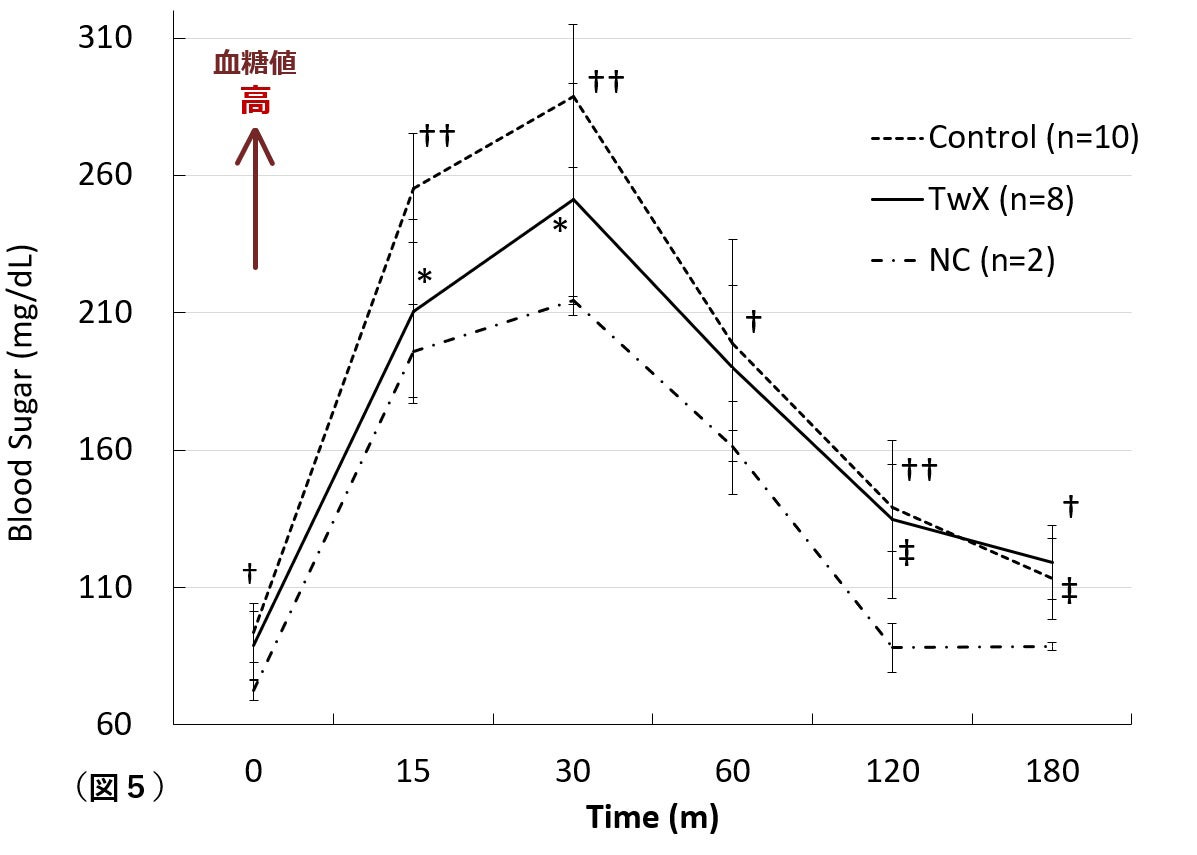
Cont:高血糖・サプリメント処置無し群、TwX: 高血糖・TwX処置群、NC: 非糖尿病群
4. オートファジー
オートファジーは、生体内の健康な細胞や細胞小器官、タンパク質、栄養素のバランスを維持するために使用されるプロセスです。オートファジーの効率は、加齢とともに低下します。神経変性疾患において、オートファジーの機能障害が報告されています。オートファジーの機能不全は、ミトコンドリア異常やシナプス損傷とともに、Aβの蓄積に加えて、ADの発症や進行、病因において起こる主要な細胞事象であることから、オートファジーを正常に保つことは重要です。
LC3微小管関連タンパク質は、オートファジー経路において不可欠な役割を果たすタンパク質です。ADの危険因子である糖尿病の脳では、LC3タンパク質が完全に消失し、オートファジーがほとんど機能していないことがわかりました。TwXを投与した同年齢の糖尿病マウスでは、LC3タンパク質の発現が見られました。TwXは糖尿病でもオートファジー機能を維持できることが示されました(図6)。
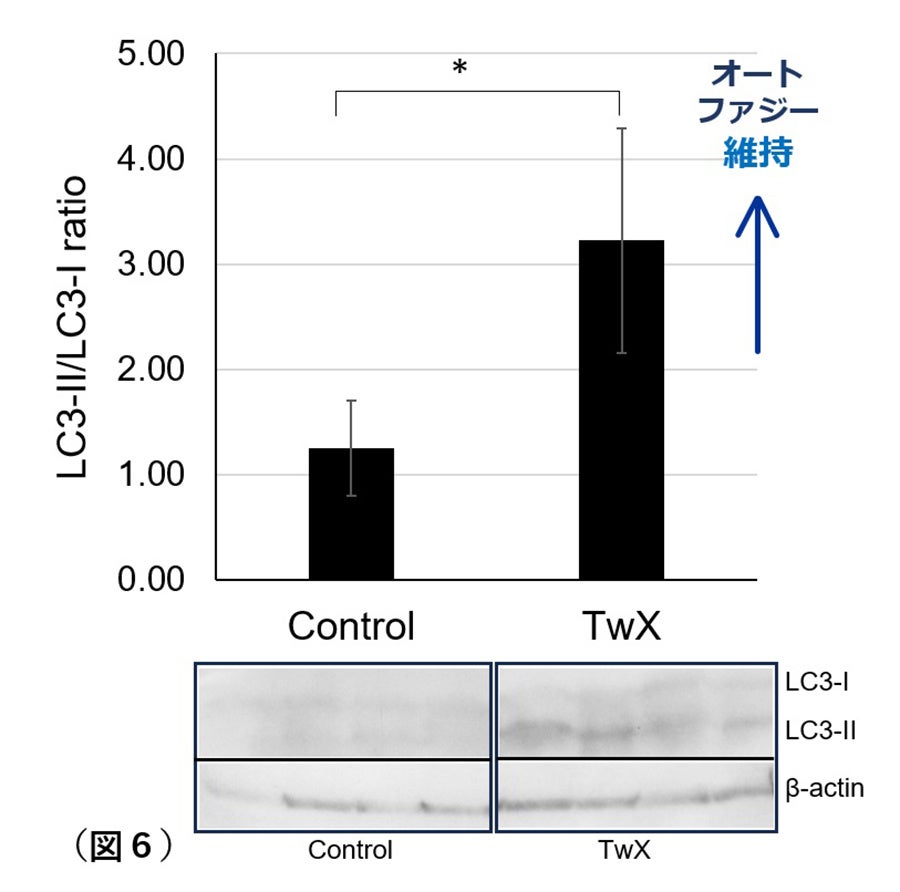
Cont:サプリメント処置無し群、TwX: TwX処置群
5. テロメアの長さ
テロメアの長さは、年齢の生物学的指標と考えられています。老化の過程で細胞が分裂するにつれて短くなります。最近では、テロメア短縮は老化関連疾患やAD発症の潜在的な要因であると報告されています。ヒトでは認知症によりテロメアが短縮する傾向があると指摘されています。テロメア短縮はADで酸化ストレス、炎症のメカニズムを介して認知機能を低下させます。ADの危険因子である糖尿病マウスにおいて、TwX投与群は同週齢の非投与群と比較して有意に長くなることが明らかになりました(図7)。老化を予防して、AD進行を抑制しているエビデンスのひとつと思われます。
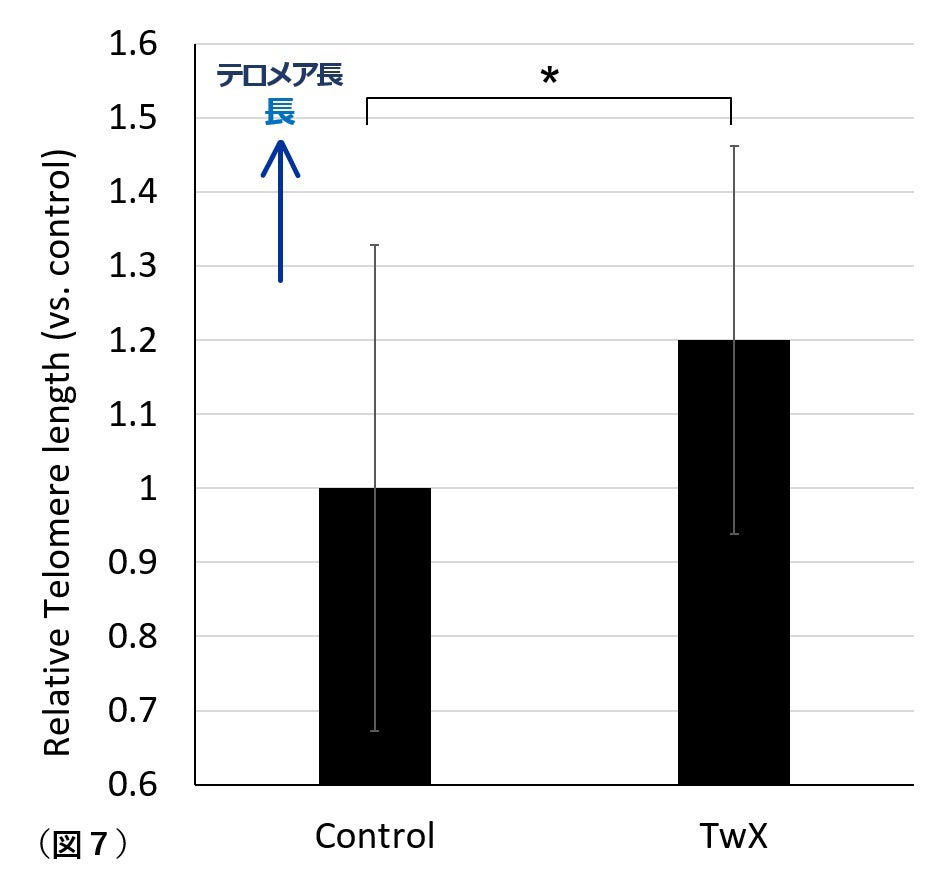
Cont:サプリメント処置無し群、TwX: TwX処置群
6. 神経新生
成体の脳では生涯を通して神経新生が起こります。しかし、老化とともに神経新生能力は低下し数が減少します。AD患者では同年齢の健常者と比較して、脳の海馬において生存可能な前駆細胞が有意に少ないと報告されています。AD脳では加齢や神経変性で失われたニューロンを補うための新生機能が欠如しています。
本論文でも高齢マウス脳において神経新生細胞数が減少することを確認しました(図8 , 56wks)。TwXを投与した同年齢の老齢マウス海馬の神経新生細胞は、若年マウス(6wks)よりもやや多いことが示されました。
TwXは加齢による神経細胞新生の低下を予防する効果が確認されました。
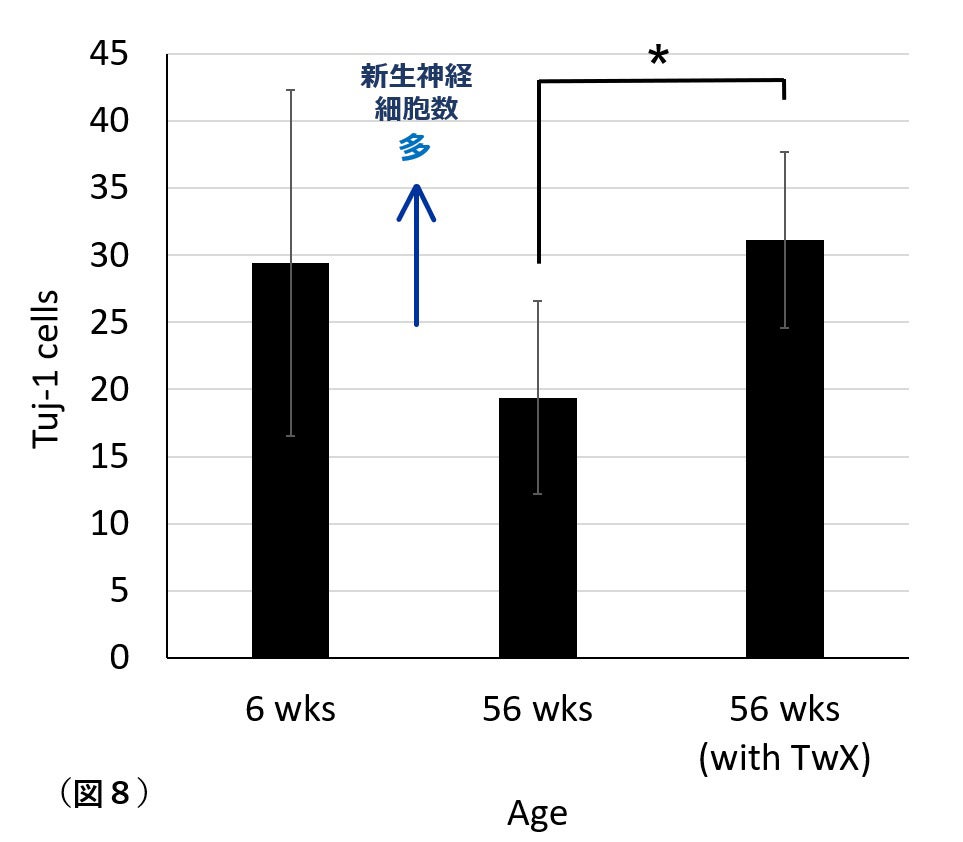
6wks:6週令(若齢)マウス、56ws:56週令(老齢)マウス、
56wks (with TwX): 56週令(老齢)マウス(TwX処置群)
■結論
Twendee X®︎は、酸化ストレスを抑えるだけでなく、血糖値の上昇やテロメアの短縮、オートファジー機能の欠落を予防します。さらにTwendee Xは、抗酸化作用でミトコンドリアを保護しエネルギー産生を確保します。
Twendee X®︎は、多くの効果により、ADモデルマウスや脳梗塞モデルマウスなどの病態の改善、最終的にはヒトの認知症の予防達成につながったと考えます。
Twendee X®︎は、軽度認知障害のみならずアルツハイマー病の進行抑制に有用である可能性が示唆されました
■雑誌紹介
雑誌:International Journal of Molecular Sciences
Section: Molecular Neurobiology
Special Issue: Cognitive Dysfunction: Molecular Research and Novel Therapy
論文:Article
Why an antioxidant complex Twendee X®︎ prevent Dementia?
Int J Mol Sci. 2023 Aug 21;24(16):13018. doi: 10.3390/ijms241613018.
PMID: 37629197
【関連論文】
1. Neuroprotective Effects of a Novel Antioxidant Mixture Twendee X in Mouse Stroke Model. J Stroke Cerebrovasc Dis. 2017 Jun;26(6):1191-1196.
2. Clinical and Pathological Benefit of Twendee X in Alzheimer’s Disease Transgenic Mice with Chronic Cerebral Hypoperfusion. J Stroke Cerebrovasc Dis. 2019 Jul;28(7):1993-2002.
3.Twendee X Ameliorates Phosphorylated Tau, α-Synuclein and Neurovascular Dysfunction in Alzheimer’s Disease Transgenic Mice With Chronic Cerebral Hypoperfusion. J Stroke Cerebrovasc Dis. 2019 Oct;28(10):104310.
4. Clinical Benefits of Antioxidative Supplement Twendee X for Mild Cognitive Impairment: A Multicenter, Randomized, Double-Blind, and Placebo-Controlled Prospective Interventional Study. J Alzheimers Dis. 2019; 71(3): 1063-1069.
5. Neuroprotective and Therapeutic Effects of Tocovid and Twendee-X on Aβ Oligomer-Induced Damage in the SH-SY5Y Cell Line. Neurodegener Dis. 2021;21(5-6):117-125.
6. Twendee X, a mixed antioxidant supplement, improves cognitive function, coordination, and neurotrophic factor expression in long-term vitamin E-deficient mice. J Clin Biochem Nutr. March 2023;72(2):93-100.
7. Considering antioxidant supplements as a means to prevent diseases. J Neurosci Neurol Disord. 2023; 7: 014-016.
-
酸化ストレスについて
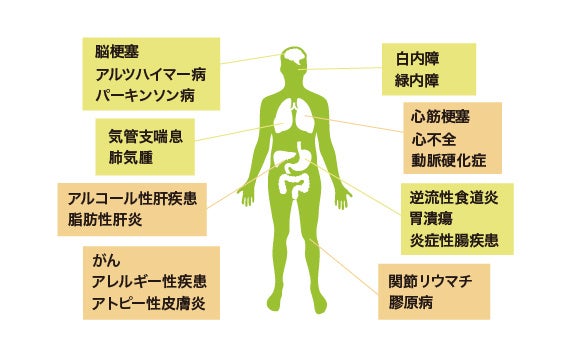
「酸化ストレス」があらゆる疾患に関連することが知られています。主原因とされる活性酸素種 (ROS)は日々の呼吸の副産物として産生されるほか、紫外線や放射線、細菌やウイルス、大気汚染などの外的因子や喫煙や大量のアルコール、そして偏食による生活習慣、病気やストレスによっても毎日産生されます。一方、体内には元々ROSを消去する働き(抗酸化力)が備わっており、これにより身体はROSによる障害を抑えることができるのです。しかし、年齢と共にその働きが衰えROSが抑えきれなくなると、細胞の障害や炎症などが起こり、実に150種類もの病気に繋がると言われています。この不均衡が酸化ストレスです。
-
組織概要

ルイ・パストゥールの理念に基づき、ウイルス性疾患や癌や難病などに関し、医学内部の専門性の境界にとらわれず、とくに各人に内在する自然免疫力の増強の観点から、基礎的・臨床的研究を行い、心身両面での、人々の病気に対する悩みを可能な限り軽減し、予防することを目標とする。
公益財団法人 ルイ・パストゥール医学研究センター
所在地:〒606-8225 京都市左京区田中門前町103-5
理事長:吉川敏一
HP:http://www.louis-pasteur.or.jp
抗酸化研究室HP:https://antioxidantres.jp
<主席研究員 犬房春彦について>

公益財団法人 ルイ・パストゥール医学研究センター 抗酸化研究室 主席研究員
岐阜大学 科学研究基盤センター 共同研究講座 抗酸化研究部門 特任教授
日本認知症予防学会 エビデンス創出委員会 実行委員、日本脳サプリメント学会 理事
-略歴‐
1982年近畿大学医学部卒業。1988年近畿大学医学部大学院外科学系卒業(医学博士)。専門は消化器外科で腹腔鏡手術、癌転移の研究。近畿大学を退職後、2007年より医療財団TIMA establishmentの主席研究員としてアルコール代謝、糖・脂質代謝、酸化ストレスの研究を開始。2013年岐阜大学 科学研究基盤センター 共同研究講座 抗酸化研究部門の新設にあたり、特任教授に就任。現在は酸化ストレスと抗酸化配合剤「Twendee X」に関する研究を行う。 2020年3月より公益財団法人 ルイ・パストゥール医学研究センター 抗酸化研究室 主席研究員。